Biotechnologie: Enzyme im Käfig
Enzyme beschleunigen als Biokatalysatoren viele chemische Reaktionen. Am Karlsruher Institut für Technologie (KIT) haben Forschende nun Enzyme in metallorganische Käfige (MOFs) eingelagert.

Enzyme beschleunigen als Biokatalysatoren viele chemische Reaktionen. Am Karlsruher Institut für Technologie (KIT) haben Forschende nun Enzyme in metallorganische Käfige (MOFs) eingelagert. Erstmals demonstrierten sie dann, dass die Stabilisierung durch diese Gerüststrukturen sogar für einen Einsatz der Enzyme in einem kontinuierlich betriebenen Reaktor ausreicht. Ebenfalls neu: Die in MOFs eingelagerten Enzyme lassen sich nicht nur in wässrigen, sondern auch in organischen Lösungsmitteln verwenden.
Sie gelten als wahre Multifunktionstalente: Enzyme beschleunigen als Katalysatoren viele chemische Reaktionen. In Organismen sind sie an lebenswichtigen Prozessen beteiligt. In Technik und Industrie ermöglichen sie als Werkzeuge der Weißen Biotechnologie, Energie zu sparen und Ressourcen zu schonen. Enzyme in Waschmitteln beispielsweise lösen Verschmutzungen schon bei niedrigeren Temperaturen. Auch Umwelttechnik, Lebensmittelverarbeitung, Arzneimittelherstellung, medizinische Diagnostik und viele weitere Bereiche setzen Enzyme ein.
Bei Enzymen handelt es sich meist um Proteine. Um das Potenzial der riesigen Moleküle auch außerhalb biologischer Kontexte in der sogenannten zellfreien Biotechnologie nutzen zu können, müssen sie stabilisiert und in effiziente Reaktorsysteme integriert werden. Diese für die Weiße Biotechnologie zentrale Herausforderung wurde in wässrigen Lösungsmitteln schon in vielen Fällen bewältigt. In organischen Lösungsmitteln dagegen kommt es häufig zu einer Destabilisierung beziehungsweise Denaturierung – die katalytischen Eigenschaften gehen verloren.
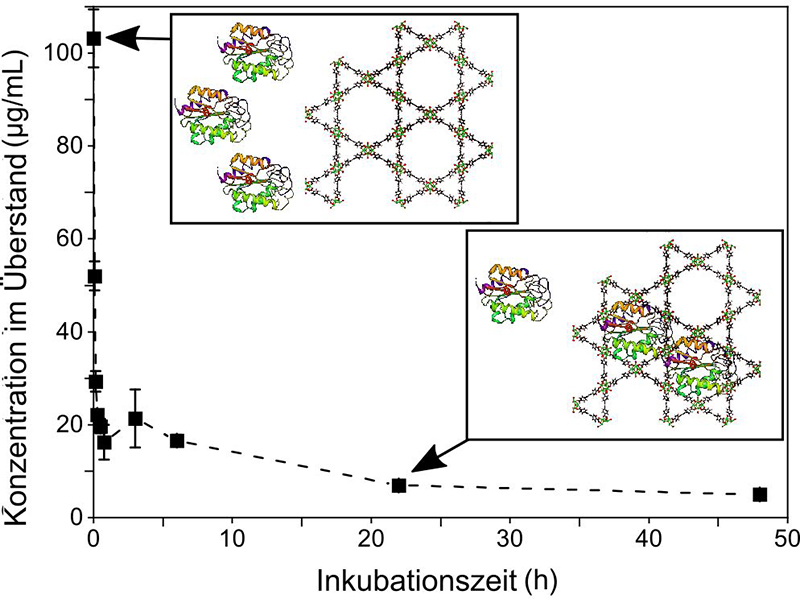
Forschenden am Institut für Funktionelle Grenzflächen (IFG), am Institut für Nanotechnologie und am Institut für Biologische Grenzflächen 1 – Biomolekulare Mikro- und Nanostrukturen des KIT ist es nun gelungen, Enzyme so zu stabilisieren, dass sie sich sowohl in wässrigen als auch in organischen Lösungsmitteln verwenden lassen. So konnten sie erstmals ein kontinuierliches Enzymreaktorsystem mit hoher Produktivität und Stabilität demonstrieren. Darüber berichten die Wissenschaftlerinnen und Wissenschaftler in der Zeitschrift Angewandte Chemie.
MOFs vereinfachen Trennung von Katalysatoren und Produkten
Das innovative Reaktorsystem basiert auf metallorganischen Verbindungen (metal-organic frameworks – MOFs). Dabei handelt es sich um Gerüste aus metallischen Knotenpunkten und organischen Verbindungsstreben, die sich durch kristalline Strukturen und definierte Porengrößen auszeichnen. Durch verschiedene Kombinationen von Metallbausteinen und organischen Liganden sowie Variationen der Porengröße lassen sich MOFs für ganz unterschiedliche Anwendungen maßschneidern. Beim zellfreien Einsatz von Enzymen wirken sie wie Käfige. „Wir bringen die Enzyme dazu, einzeln in die Poren der MOFs einzudiffundieren, das heißt, sozusagen freiwillig in den Käfig hineinzuschlüpfen“, erklärt Professor Christof Wöll, Leiter des IFG. „Die MOFs wirken als Rüstung, schützen diese empfindlichen Biomoleküle und vermeiden Denaturierung.“ Dank der Porosität der MOFs lässt sich der Transport von Reaktanten, also der Substanzen, die während der chemischen Reaktionen verbraucht werden, und Produkten, die dabei entstehen, besser kontrollieren. Darüber hinaus vereinfachen die MOFs die aufwendige Trennung von Katalysator und Produkten, wie Professor Matthias Franzreb erläutert, stellvertretender Leiter des IFG und Co-Autor der Studie.
Die Karlsruher Forschenden demonstrierten die zeit- und kosteneffiziente Herstellung eines Enzym-MOF-Durchflussreaktors. Dabei war die Stabilität des immobilisierten Enzyms rund 30-mal so hoch wie die des freien Enzyms. Die katalytische Aktivität betrug im Vergleich zum freien Enzym rund 30 Prozent – ein angesichts der Verformung des in die MOF-Poren eingebetteten Enzyms recht hoher Wert. Die Studie lief im Kontext des Exzellenzclusters „3D Matter Made to Order“ des KIT und der Universität Heidelberg sowie des Helmholtz-Programms „Materials Systems Engineering“. In weiteren Arbeiten zum Thema ist geplant, die MOFs mithilfe computerbasierter Methoden so zu verändern, dass die Verformung durch die Poren nicht zu einer Verringerung, sondern zu einer Erhöhung der Aktivität führt.







